CSL riceve parere positivo dal CHMP per garadacimab nel trattamento dell’angioedema ereditario (HAE)
Dopo approvazione UE, sarà disponibile come trattamento a singola somministrazione mensile che inibisce il Fattore XIIa per la prevenzione degli attacchi nei pazienti con HAE
Il Comitato per i Medicinali per Uso Umano (CHMP) dell’Agenzia Europea per i Medicinali (EMA) ha emesso un parere positivo raccomandando il rilascio dell’autorizzazione all’immissione in commercio per garadacimab come trattamento di profilassi – con somministrazione una volta al mese – per l’angioedema ereditario (HAE) in pazienti adulti e adolescenti dai 12 anni in su. Lo ha annunciato CSL (ASX: CSL; USOTC: CSLLY), leader globale in biotecnologie. Garadacimab è un anticorpo monoclonale ricombinante, che inibisce il fattore XII attivato (FXIIa) una proteina plasmatica a monte della cascata della chinina-callicreina che porta all’insorgenza degli attacchi di angioedema ereditario. La decisione finale della Commissione europea è attesa nel primo trimestre del 2025 e sarà valida in tutti gli Stati membri della UE.
"La storia di CSL si intreccia fortemente con l’evoluzione terapeutica dell’angioedema ereditario: grazie al C1-inibitore derivato dal plasma umano è cambiata la vita delle persone con HAE, prima con la formulazione endovenosa per il trattamento degli attacchi acuti, poi con la formulazione sottocutanea per la prevenzione degli attacchi. Oggi compiamo un ulteriore passo avanti con garadacimab, anticorpo monoclonale umanizzato anti-fattore XIIa che potenzialmente può rendere i pazienti liberi dai sintomi dell’HAE – ricorda Oliver Schmitt, Amministratore Delegato, CSL Behring Italia – La nostra azienda ha una consolidata esperienza sulla patologia ed è costantemente impegnata a migliorare la vita delle persone con angioedema ereditario cercando di rispondere ai loro bisogni con nuove proposte terapeutiche".
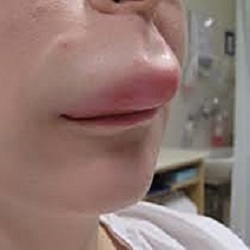
Gli attacchi di angioedema ereditario sono spesso dolorosi, non prevedibili e possono colpire diverse aree del corpo, inclusi l’addome, la laringe, il viso e le estremità. La attuali terapie di prevenzione hanno come target dei mediatori situati a valle della cascata di chinina-callicreina, ma non prevengono la cascata stessa dalle sue primissime fasi.
Il parere positivo del CHMP è basato sui dati provenienti dal trial registrativo di fase III controllato con placebo VANGUARD e dalla sua fase di estensione in aperto, che hanno valutato l’efficacia e la sicurezza di garadacimab. Lo studio registrativo ha raggiungo l’endpoint primario dimostrando che garadacimab ha permesso al 62% dei pazienti di non avere attacchi durante il periodo di trattamento, azzerando il numero mediano degli attacchi e riducendo il numero medio degli attacchi dell’86,5% rispetto al placebo. L’analisi ad interim dello studio di estensione tutt’ora in corso (esposizione a garadacimab mediana di 13,8 mesi) ha mostrato che garadacimab presenta un profilo di sicurezza favorevole e una riduzione efficace degli attacchi mantenuti nel lungo termine. I risultati completi dello studio VANGUARD sono stati pubblicati sul numero di aprile 2023 di The Lancet e i risultati primari dello studio di estensione sono stati pubblicati sul numero di ottobre 2024 di Allergy.
L’opinione del CHMP è stata pubblicata sul sito di EMA.
A proposito dell’angioedema ereditario (HAE)
L’HAE è una rara condizione di origine genetica, potenzialmente fatale, che si presenta in circa una persona ogni 10mila-50mila. L’angioedema ereditario è causato da una carenza o una disfunzione di C1-INH, una proteina presente nel sangue che aiuta a controllare le infiammazioni. Una quantità insufficiente o un cattivo funzionamento di C1-INH può portare all’accumulo di fluidi nei tessuti del corpo, causando un grave gonfiore definito angioedema. Gli attacchi di angioedema possono colpire, anche contemporaneamente, diverse parti del corpo, tra cui il viso, l’addome, la laringe, le estremità. I pazienti che hanno attacchi di HAE all’addome possono sperimentare dolori molto forti, diarrea, nausea e vomito causati dal gonfiore delle pareti intestinali. Gli attacchi di HAE che colpiscono il viso o la gola possono manifestarsi con chiusura delle vie aeree e asfissia e, se non trattati, possono portare anche alla morte.
I Correlati
COSIsiFA l’informazione targata AIFA: una sfida ambiziosa, ma concretamente realizzabile?
L'obiettivo è di "spezzare il monopolio dell’industria farmaceutica sull’informazione dei medicinali per veicolare verso gli operatori sanitari le informazioni scientifiche e portare i cittadini verso un uso appropriato dei farmaci"
Dal 4 al 10 febbraio 2025 le giornate di raccolta del farmaco
Banco Farmaceutico rinnova il suo appello ai farmacisti italiani perché il maggior numero di essi aderisca a questo gesto di gratuità
Negli Stati Uniti spopola il microdosaggio del farmaco antiobesità, il timore dei medici
Allarme sulla cascata di effetti collaterali, che vanno dall' uso di medicine scadute all' acquisto di 'imitazioni' create e vendute in farmacie che non usano la formula originale
Terapia CAR-T ciltacabtagene autoleucel; tassi di negatività minima più elevati rispetto alle terapie standard per il mieloma multiplo
La terapia ciltacabtagene autoleucel rappresenta la prima terapia cellulare ad aver prolungato significativamente la sopravvivenza globale (OS) rispetto alle terapie standard in pazienti con mieloma multiplo
Ti potrebbero interessare
Rimborsabile mirikizumab contro la colite ulcerosa
Via libera da Aifa, riduce i sintomi intestinali senza l'uso di steroidi
Fibrosi polmonare, Nerandomilast potenziale trattamento orale
Lo studio sperimentale di fase III è stata la più ampia sperimentazione sulla fibrosi polmonare idiopatica (IPF) ad oggi mai condotta, in corso presso circa 400 centri e in oltre 30 Paesi
Per resistenze ad antibiotici 39 milioni di morti entro il 2050
Lo rivela la prima analisi globale sull'argomento pubblicata sulla rivista The Lancet e condotta dal Global Research on Antimicrobial Resistance (Gram) Project
Nature, il cervello è invecchiato più lentamente nelle scimmie a cui è stata somministrata la metformina
La dose giornaliera del farmaco contro il diabete ha preservato la cognizione e ritardato il declino di alcuni tessuti
Ultime News
Sifo, ritirato l'emendamento che avrebbe favorito laureati senza specializzazione
Cavaliere: "Non possiamo che ringraziare il ministro Schillaci, il sottosegretario Gemmato e gli uffici ministeriali per la loro azione rapida e incisiva, che ha portato al ritiro dell’emendamento in questione"
Da Telethon altri 36 progetti contro le malattie genetiche rare
Assegnati oltre 6 milioni in 9 regioni grazie a donazioni
Vecchia e longeva, l'Italia senza più figli
Istat, un bimbo ogni sei over65. L'età media sale a oltre 46 anni
Cassazione, il medico ha il dovere di discostarsi dalle linee guida se le condizioni del paziente e le buone prassi lo richiedono
"Il rispetto delle linee guida che, a causa delle condizioni del paziente, si rivelino inadeguate al caso, così suggerendo altra terapia secondo buona prassi medica, non esonerano il sanitario da colpa grave in caso di morte"











Commenti